CRO(開発業務受託機関)では、様々な医薬品や医療機器の治験業務を受託しており、日々、新たな治療法の開発に寄与しております。
今日では新たな領域として再生医療等製品の開発が活発になっており、レメディでも、多様な再生医療等製品の開発(治験、臨床研究)に従事しております。
再生医療と聞くと、iPS細胞やES細胞を用いたようなものを想像する方も多いのではないでしょうか。さらに再生医療等製品の治験というと、従来の医薬品の治験とは異なっており、どこか難しいというイメージを持つ方もいるのではないでしょうか。
今回は、「再生医療等製品」における「治験」とは、どういったものなのか、ご説明していきたいと思います。
治験を実施するにあたり遵守することが定められているGCP省令(Good clinical practice:臨床試験の実施の基準に関する省令)は、医薬品・医療機器・再生医療等製品それぞれ定められておりますが、基本的な考え方は全て共通しており、「被験者の人権の保護、安全の保持、福祉の向上」を最も重視して、治験による「科学的な質及び成績の信頼性を確保」することを目的としております。
どんなに科学的、社会的に重要であっても、被験者の不利益にならないよう慎重に配慮することが求められています。
医薬品治験と再生医療等製品治験の違い
それでは、医薬品治験と再生医療等製品治験では具体的に何が異なるのでしょうか。
前述の通り、医薬品の治験においても再生医療等製品の治験においても基本となる目的は変わらないため、実際の治験の流れなど、大きな違いはあまりありません。
そもそも再生医療等製品とは、「遺伝子や細胞を使って疾患を治療、予防する製品」のことであり、再生医療のみを指しているとは限らないからです。細胞を用いて軟骨や皮膚といった組織の修復を目的とするものもありますが、遺伝子ベクターや遺伝子導入細胞を用いてがんを治療するような製品も再生医療等製品に分類されます。
> 再生医療コラム:DNAと遺伝子治療(別ウインドウで開きます)
しかし、再生医療等製品特有の治験留意点は多岐にわたります。
まず、体制です。再生医療等製品は、生きた細胞や遺伝子を使用するため、製造や輸送過程での管理体制や、医療機関において製品を使用する際の体制について厳格に定めておく必要があります。
そこで、治験を行う病院が治験製品を使用するうえで適格かどうか、製品の特徴を考慮して慎重に確認する必要があります。
通常の医薬品治験においても医療機関が治験を実施するうえで適格であるかの調査を行いますが、再生医療等製品においては、製品の使用期限が2~3日程度しかないものも多いため、細胞培養加工施設(製造工場)から施設までの輸送ルートなども加味して慎重に施設を調査していく必要がでてきます。
> 再生医療コラム:再生医療領域開発の実施環境が整うまで(別ウインドウで開きます)
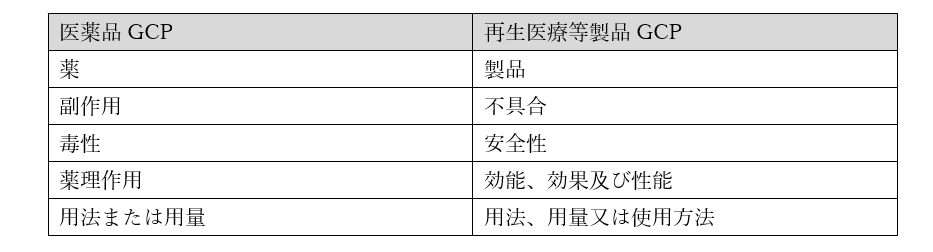
次に大事な違いが、有害事象(副作用)の扱いです。
医薬品の治験においては、薬を使用した被験者に生じた、治験薬との因果関係が否定できない有害事象(副作用)の情報を収集しますが、再生医療等製品治験においては、被験者に生じた有害事象のみならず、製品自体の不具合がないかについても確認し、あわせて「安全性情報」として情報を収集します。
また、有害事象の中でも死亡や入院といった重篤な有害事象が認められた場合、通常その情報を知り得てから24時間以内の治験依頼者への緊急報告、並びに重篤性の基準ごとに定められた期日までに当局への報告が必要となります。
再生医療等製品治験の場合、実際に有害事象が生じていなくても、重篤な有害事象が生じる“おそれ”があると認められた時は、重篤な有害事象が発生した時と同様に緊急報告が必要となります。
その他、製品を使用する際の調製方法、手術・手技の教育訓練が必要な場合があったり、医薬品・医療機器とのコンビネーション製品の場合は、組み合わせる製品により報告方法が変わったりなど、製品ごとの特徴によって確認しなければならない事項は多岐にわたります。

再生医療等製品の開発に従事する者には、細胞培養や遺伝子工学等の専門的及び科学的な知識と、それらの内容を当局、医療関係者、患者など、様々なステークホルダーに分かりやすく伝える能力が求められます。
レメディグループでは、GCPの知識をベースとして、さらに再生医療の専門的な研修を行っております。これによって基本的な治験業務を十分に実施でき、再生医療等製品治験へも対応可能なスペシャリストを育成しており、これまでも多種多様な製品の開発に携わっている実績がございます。
今後ますます市場が拡大していくことが期待される再生医療等製品の分野において、開発に関するご相談等がありましたら、レメディグループまでお問い合わせください。