再生医療三法
2013年の日本再興戦略において、再生医療等製品を取り巻く法律に焦点が当てられた。2012年には山中伸弥先生がノーベル賞を受賞している一方で、再生医療等製品は米国9製品、韓国14製品と比較し、日本はわずか2製品に留まっている。
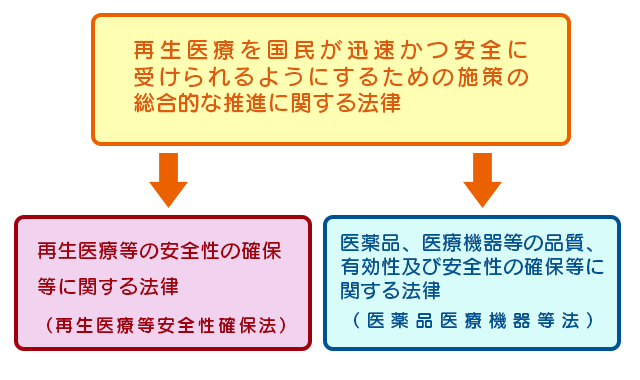
そこで、再生医療を国民が迅速かつ安全に受けられるようにする為、再生医療の研究開発から実用化までの施策の総合的な推進を図ることを目的として、議員立法で「再生医療を国民が迅速かつ安全に受けられるようにするための施策の総合的な推進に関する法律」が制定された。
この法律では、再生医療の研究、開発、普及の為の具体的な施策を講じることを求めており、これを受けて、薬事法が改正され「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」(以下、薬機法)となり、「再生医療等の安全性の確保等に関する法律」(以下、再生医療等安全性確保法)が制定された(図1)。
一般的には、薬機法は、細胞加工物等を薬事承認を受けて「再生医療等製品」として製造、販売することを規制する法律となっている。
> 再生医療コラム:再生医療に関する法律 その2(別ウインドウで開きます)
一方、再生医療等安全性確保法は、細胞加工物のうち、再生医療等製品ではないものを、臨床研究又は自由診療として提供することを規制する法律となっており、適用範囲が異なる。
薬機法
薬機法では、これまで医薬品あるいは医療機器に分類されていた細胞治療、遺伝子治療用製品を、再生医療等製品という独立したカテゴリとして定義した(表1)。また、再生医療等製品はその特性により従来の医薬品、医療機器と同様のデータの収集が困難であることから、条件及び期限付き承認制度が導入された(図2)。
表1 再生医療等製品の種類
ヒト細胞加工製品
- 一. ヒト体細胞加工製品(次号及び第四号に掲げる物を除く。)
- 二. ヒト体性幹細胞加工製品(第四号に掲げる物を除く。)
- 三. ヒト胚性幹細胞加工製品
- 四. ヒト人工多能性幹細胞加工製品
動物細胞加工製品
- 一. 動物体細胞加工製品(次号及び第四号に掲げる物を除く。)
- 二. 動物体性幹細胞加工製品(第四号に掲げる物を除く。)
- 三. 動物胚性幹細胞加工製品
- 四. 動物人工多能性幹細胞加工製品
遺伝子治療用製品
- 一. プラスミドベクター製品
- 二. ウイルスベクター製品
- 三. 遺伝子発現治療製品(前二号に掲げる物を除く。)
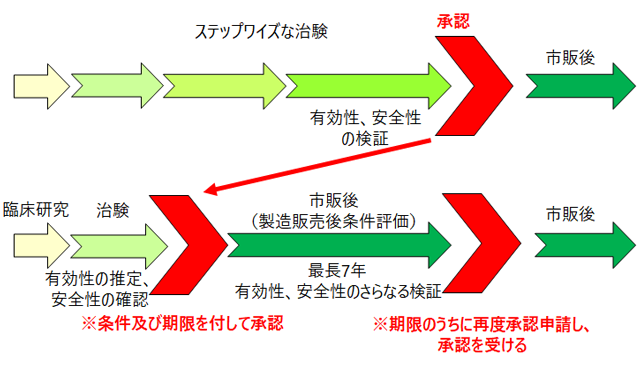
条件及び期限付き承認制度は、再生医療等製品の承認制度の特徴的なものであり、薬機法において以下のように定められている。
(条件及び期限付承認)
第二十三条の二十六 前条第一項の承認の申請者が製造販売をしようとする物が、次の各号のいずれにも該当する再生医療等製品である場合には、厚生労働大臣は、同条第二項第三号イ及びロの規定にかかわらず、薬事・食品衛生審議会の意見を聴いて、その適正な使用の確保のために必要な条件及び七年を超えない範囲内の期限を付してその品目に係る同条第一項の承認を与えることができる。
- 一. 申請に係る再生医療等製品が均質でないこと。
- 二. 申請に係る効能、効果又は性能を有すると推定されるものであること。
- 三. 申請に係る効能、効果又は性能に比して著しく有害な作用を有することにより再生医療等製品として使用価値がないと推定されるものでないこと。
上記の記載があるものの、コラテジェン® (ベペルミノゲン ペルプラスミド)のように、比較的均質と考えられるプラスミド製品が条件及び期限付承認を受ける例もある為、開発にあたっては、当局との相談制度を活用することが肝要である。
> 再生医療コラム:再生医療等製品治験と医薬品治験の違い(別ウインドウで開きます)
※次回コラムも引き続き再生医療に関する法令の解説を掲載の予定です。