今回のOncology times intellimでは、海外監査の実態についてインテリム監査部門の冨山室⾧の見解を聞きました。その内容は、今月号と来月号の2回にわたってお送りする予定です。
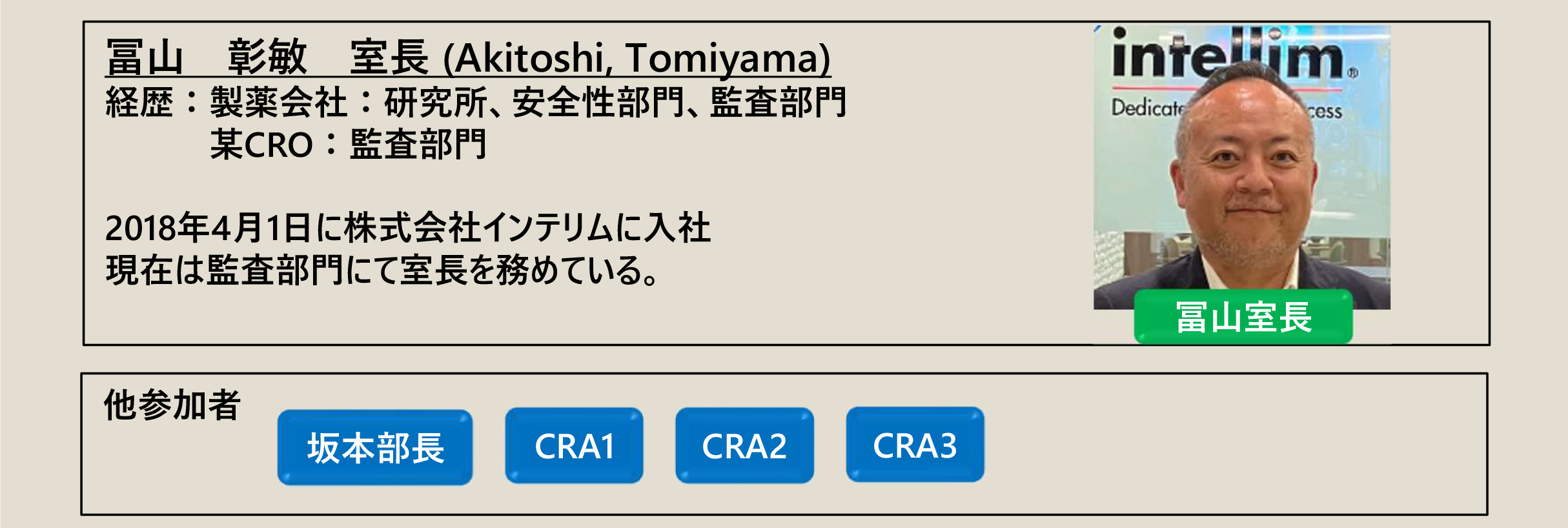
海外監査について
今回は海外監査について感想などお話をお聞きできればと思っています。最初の質問として、海外の監査ならではの驚かれた話などありましたらお願いします。
冨山室⾧
海外と日本の監査とでは色々と違うだろうと想像していると思います。しかしながら文書関連はほとんど同じで、ただ原資料の言語が違うだけです。あとはそんなに大きな違いがないと感じています。ただし、その国々の事情で作成しなければならない特殊な文書はあります。それを除くとそれほど違いはありません。
坂本部⾧
これまで何か国くらい監査訪問されたことがあるのでしょうか。
冨山室⾧
5か国です。中国、韓国、台湾、ベトナムとタイです。
坂本部⾧
結構、行かれてるのですね。現地で使われる言葉は英語ですか。
冨山室⾧
監査は、現地の言葉と日本語で行い、あまり間に英語を挟まないようにしています。
坂本部⾧
そうすると通訳が同行するのでしょうか。
冨山室⾧
弊社の場合は、訪問する国の現地の言葉と日本語の両方を話せる社員と一緒に監査に行きます。前職では、現地に社員がいる国への監査もあれば、別途通訳を連れて行ったこともあります。そのようにしているのは自分が昔、苦い経験をしたためです。
坂本部⾧
苦い経験というのは?
冨山室⾧
人生で初めて海外監査を行った時、一緒に訪問したメンバーは日本人1名、ヨーロッパから2名で、全て英語をベースにして監査を進めていました。最後のクロージング・ミーティングの時に、監査責任者が英語で所見を説明しました。それに対して担当モニターが説明しようとしたら、先生が現地語で何か早口で言われて、それを私たちは何も理解できず、担当モニターは黙ってしまったんです。
その後、先生とCRCさんが現地語で話し始めて、そうすると私たちは、何を話しているか理解できずにお手上げでした。
坂本部⾧
その状況では現地語が理解できないと厳しいですね。
冨山室⾧
最後に監査責任者が「今まで現地語で何を話されていたのですか?」と先生に尋ねたら「今言われたことに対しての確認です。」と返事があっただけで、結局何を話していたのかは分かりませんでした。
後日、監査に同席した担当モニターに現地語で何を言われたのか確認したら、先生から「あなたは黙っていなさい。」と言われたとのこと。その他に私たちが出した指摘事項に対して先生が「何でこんなことになっているのだ。」、「あなた達が何かミスをしたのか。」というやりとりがあって、最終的には先生が自分で指摘事項を解決したということでした。
このようなことがあって、監査側に現地の言葉が分かる人を連れて行かないと、向こうはそのようなことをする。それが決して100%悪いということではないのですが、その中に不正や隠ぺいに繋がることもあり得るという観点から、依頼者や自分たちを守るためにも、これ以後の監査では現地の言葉が分かる人を連れて行くようにしています。

坂本部⾧
本人たちは隠そうという意図がなくとも、勘ぐられてしまうということですね。
冨山室⾧
はい、そうです。逆にEMAやFDAから日本に査察に来る場合は、会話言語は英語のみになります。日本語を話すと怒られてしまう。それは何か隠しているのではないかとあらぬ疑いが起こることを防ぐためだと思います。
一方、私が海外監査の依頼を受けた場合は、現地の言葉での会話を提案させていただいています。承認申請前の監査で、所見になることを見出せなかったら意味がありません。初めての海外監査での苦い経験から、このようなことを二度としたくないと思っています。
CRA1
日本の監査ではモニターの立ち合い不可の場合が多い印象ですが、海外の場合はモニターが立ち会うのが普通でしょうか。
冨山室⾧
私が以前勤務した外資系メーカーではそれが普通でした。一方、内資系メーカーの時は、あまりモニターが立会うのは良くないとされていました。私は数々の監査を通じて、立ち合いに関して柔軟な対応をするようにしてきました。モニターが立ち会っていることで医療機関へ負担を掛けない、問題があった時にまずモニターへ聞けばそこで解決することが多いことも事実です。もう一点は、その場でどちらの意見が本当なのか検証できるというメリットもあります。
CRA1
PMDAによる国内の実地調査の際は、モニターの立ち合いは不可でしょうか。
冨山室⾧
不可です。一方、FDAやEMAの査察の場合、そのプロジェクトに関わる人は同席するようにとのスタンスです。それは、何か問題があっても、それに関係する人がいれば、その場で解決できるというメリットのためだと思います。もし揃っていないとなると時間を空けて聞くことになるので、それによって見いだした疑問点について対応されてしまうということがあると思います。そのようなことを防ぐためだと思います。
CRA1
日本と海外は違いますね。
海外監査について
今まで言語の違いにより苦労した経験を中心に話をしてもらいましたが、delegation logについては如何でしょうか。
冨山室⾧
責任医師よりdelegateされるべき業務内容が、きちんとdelegateされるべき人にdelegateされていないということがあります。
CRA2
責任範囲でしょうか。
冨山室⾧
それがほとんどです。国によっては医療機関の体制に起因するものもあります。例えばベトナムでは、本院の下にいくつかの病院がぶら下がっている組織体制でした。分院が実施医療機関として治験を実施しており、そこで監査を行いました。
実際のdelegation logを見ると、治験責任・分担医師は実施医療機関の所属でしたが、本院のスタッフも協力者として載っていました。
実施医療機関のスタッフではないので、治験実施体制として相応しくないと指摘しました。本院も含めてひとつの実施医療機関として協力してやっているとの回答でした。しかし、すべての業務をdelegationされていなかったりして、担当者を探すのに苦労しました。
CRA1
その観点からいくと契約書も契約形態が異なったりして苦労されているのではないでしょうか。
冨山室⾧
詳細までは確認できないというところがあり、それを訳していたら大変です。
CRA1
契約書の枚数が、日本より多いなど海外では違うのでしょうか。
冨山室⾧
そこまで違う印象はありません。事前に契約書を入手している場合は内容を確認します。CROの場合は、自分たちの会社が関わっている治験契約の場合は確認できます。一方、完全な第三者となる場合は、現地でしか確認できないので、監査時に限られた時間内で見るのは苦労します。
CRA1
契約書は現地語で書かれているのでしょうか。
冨山室⾧
依頼者の書式を用いているので英語の場合がほとんどです。ただ検査会社などのベンダー関連は現地語で締結されている印象です。
CRA1
カルテも現地語だと思います。その時は通訳の方が読まれるのでしょうか。
冨山室⾧
臨床検査値などは共通なのであまり苦労しません。苦労するのは医師の所見です。有害事象に繋がるようなことが現地語で書かれているので、そこが一番大変です。慣れてくると、段々理解できます。どこの国でも大体所見は、見ていると少しずつ慣れてきます。ただ監査は2日程の時間なので限度があります。
坂本本部長
どの国の監査も2日間なのでしょうか。

冨山室⾧
大体2日間です。それ以上、予約してくださる所もありますが、それ相応の理由がないと延長は難しいです。
坂本本部長
それでは事前に必要書類をレビューしておかないと、現地でカルテ等の原資料を見る時間が限られてしまいますね。
冨山室⾧
以前の監査は、症例をサンプリング、そして一通り必須文書を確認するという方法でしたが、今ではリスクがありそうなところを押さえていくかたちです。
IRB関連記録も全て見るのではなく、重要な逸脱やSAEが適切なタイミングでIRB審議されているのかなど、リスクベースで確認するように変わってきています。事前に全ての書類をレビューするというよりは、確認すべきポイントを押さえて確認してくれば良いというところです。
坂本本部長
事前に提出を依頼した書類があるにも関わらず、提出されないケースがあるでしょうか。
冨山室⾧
ありますね。
坂本本部長
そういう場合、再依頼してすんなり出てくるものでしょうか。
冨山室⾧
該当するのは契約書やSOPの原本です。原本を管理しているところから出すという行為自体があまりないようです。SOPのコピーで対応してくださいと言われて交渉したのですが、それは叶わないことがありました。

坂本本部長
基本はオリジナルということで進むのですよね。どうしても無理であれば、最後の手段としてコピーで対応するのですか。
冨山室⾧
そうなります。コピーさえも出てこなかったら、そういうことを聞いたという事実ベースでしか対応できません。その結果、それに由来する問題が発生した場合は、医療機関側の責任ということになりますが、最低限のところまでの言質は取って帰ってこなければなりません。
CRA1
病院ごとに違いがありましたでしょうか。
冨山室⾧
基本的には大学病院とか大規模病院には差はありません。私の参加した海外監査では、クリニックが治験に参加することはなかったので、一概に比較はできません。しかし、大きな病院ではそんなに違いは無いと感じています。ただ、海外は監査の際も意外とオープンというか、窓は開けっぱなしで、色んな人が外から見ているような環境だったので、あまりいい感じがしませんでした。
坂本本部長
監査の範疇で考えて興味深いところは他にありますでしょうか。
冨山室⾧
海外の監査では、監査担当者も医療機関側の先生方も全員対等な感じを受けました。治験責任医師の先生でさえ私たちにフランクに話しかけてくれて、何か問題があったら遠慮なく言ってください、改善して、自分たちも勉強してどんどん成長していきたいのだという話をしてくださる先生が多いです。
坂本本部長
公平な考え方をする方が多いのですね。
冨山室⾧
そうです。一旦、監査担当者からの指摘を素直に受け入れるという姿勢があると思います。具体的な事例として私の個人的感想ではタイの医療機関は日本より堅実かもしれないと思いました。こちらが要求したものはちゃんと出てくるし、指摘に対して、「それはどうしてそうなるのか」と質問を返されて、こちらからその根拠はこうですとやり取りが普通にできます。日本だと「何でそんな指摘をするのですか」から始まることもあります。
坂本本部長
反発から入ってこられるように感じますでしょうか。
冨山室⾧
情的な対応が比較的見えるような印象です。海外の医療機関の監査の時は、感情的な対応をあまり感じないように思います。
坂本本部長
それでは指摘しにくいですね。
冨山室⾧
国内の病院で全てがきっちり決まっているようなところでは、一つの指摘が、その治験のみならず病院全体に及ぶかのように誤解を招きがちで、それがどんなことになるのか心配されるところもあるかもしれません。
CRA3
監査の指摘を受け入れていただくのは大変なのですね。
冨山室⾧
もちろん、私たちが丁寧に、理解しやすいように説明することが前提です。例えば、私はALCOAを日本でも導入し始めたころに、監査担当になりました。当時、監査担当としてALCOAを普及するというのは、本当に難儀でした。
どの医療機関に行ってもCRCさんや先生に受け入れてもらえない時期がありました。それこそまさに改善どころではなくて、もう慣れたやり方でやるのが一番みたいなそんな感じでした。当時は大変でした。……

全文&最新号は
メールマガジン「Oncology times intellim」にて
メールマガジン「Oncology times intellim」では、弊社の取り組みやKOLへのインタビューなどを定期的にお届けしております。ぜひ下記フォームよりお申込みください!
バックナンバーについてのお問い合わせもこちらからご連絡ください。