平成25年に制定された再生医療等の安全性の確保等に関する法律(以下、再生医療等安全性確保法)により、従来、医師の裁量権の範囲として規制がなかった細胞加工物を用いた自由診療に、事前規制の網がかぶせられることとなった。
また、再生医療等安全性確保法では、臨床研究として実施される再生医療についても規制されることとなった。 ただし、二重規制を避けるため、他の法律で既に規制を受けているものについては適用除外となっている。具体的には、医薬品、医療機器等の品質、有効性、安全性の確保等に関する法律(以下、薬機法)において規制される再生医療等製品及び再生医療等製品となることが見込まれる加工細胞等の治験、並びに、移植に用いる造血幹細胞の適切な提供の推進に関する法律及び同法施行規則で規制されるものについても、再生医療等安全性確保法の適用除外となっている。
また、再生医療等安全性確保法で規制するものは細胞加工物のうち、薬機法上の再生医療等製品を除いた特定細胞加工物のみであり、プラスミドベクター、ウイルスベクターのような遺伝子治療は適用対象外となっており、遺伝子治療の臨床研究は臨床研究法により規制される。遺伝子治療の自由診療については規制する法律は存在していないことが課題となっている。
> 再生医療コラム:再生医療に関する法律 その3(別ウインドウで開きます)
表1 適用法
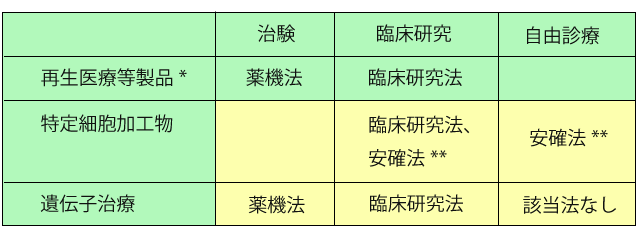
** 再生医療等安全性確保法
再生医療等安全性確保法における再生医療等技術の分類
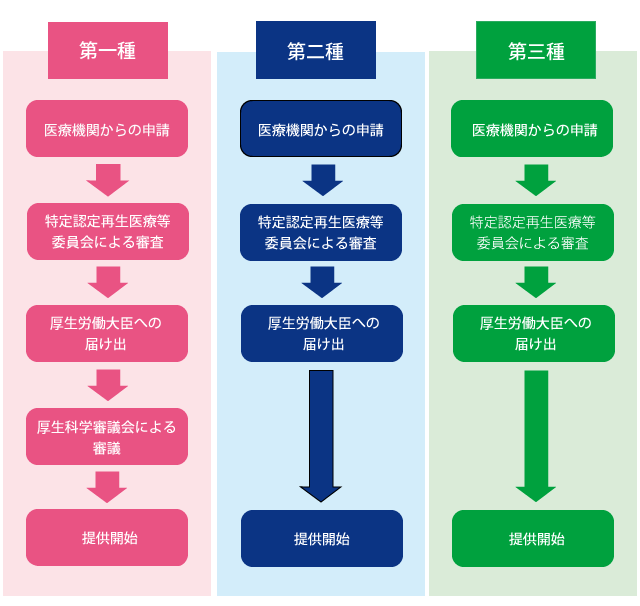
再生医療等安全性確保法では、再生医療等技術を、そのリスクにより第一種、第二種、第三種に分類している。 ES細胞やiPS細胞のような多能性幹細胞、遺伝子導入細胞、動物細胞及び他家細胞を用いる再生医療等技術は第一種に分類される。自家幹細胞においては、培養を行っている場合、もしくは培養を行っていないが非相同利用の場合に第二種に分類される。培養を行っていない、かつ相同利用であれば第三種に分類される。
> 再生医療コラム:細胞加工製品とは?(別ウインドウで開きます)
自家細胞においては、体細胞を身体の構造又は機能の再建、修復又は形成を目的として培養を行っている場合、または培養は行っていないが非相同利用の場合は第二種となる。培養を行っていない、かつ相同利用は第三種に分類される。体細胞を用いているが、身体の構造又は機能の再建、修復又は形成を目的としていない技術であっても、非相同利用であれば第二種、相同利用であれば第三種に分類される。
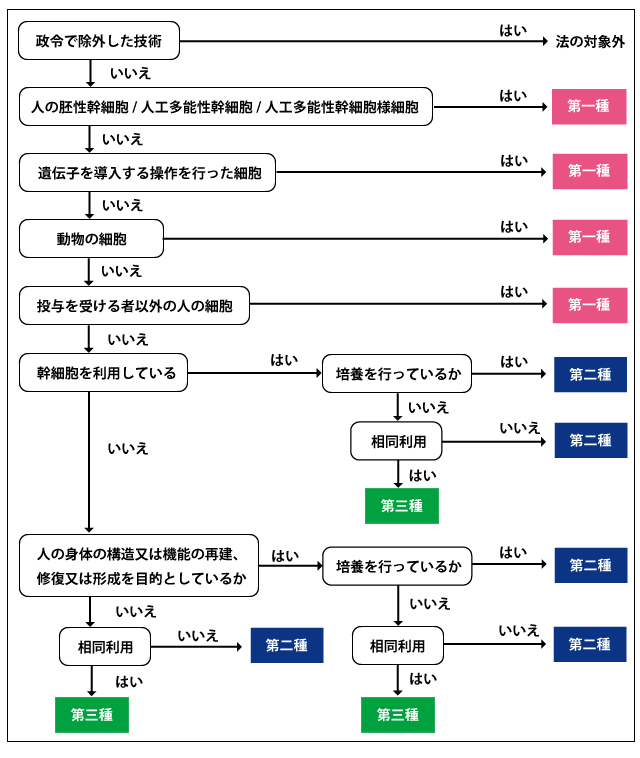
再生医療を臨床研究あるいは自由診療として提供しようとする場合、事前に認定再生医療等委員会での審議、承認を得た後、厚生労働大臣に届け出を行い、その情報を公表する必要がある。第一種及び第二種は、特定認定再生医療等委員会、第三種は認定再生医療等委員会での審議となる。また、第一種については、届出後、厚生科学審議会の意見を聞く必要があり、その期間として、90日間の提供制限期間が設けられている。