概要
生物学的同等性試験(BE)は、二つの医薬品における生体内の生物学的同一性を評価する為に行われる。BE試験に対する海外の規制は、日本と比較すると大きく異なる。この記事では、日本と台湾のBE試験における違いを紹介する。
> English version of this article is also available. See it here.(This will open in a new window.)
 まず、試験の目的を例として挙げる。日本では、BE試験は革新的な医薬品に対して、ジェネリック医薬品の治療上の同等性を保証する為に行われる。一方、台湾では、このような試験は、剤形・処方・製造工程・製造者などに変更があった際にも行われる。
まず、試験の目的を例として挙げる。日本では、BE試験は革新的な医薬品に対して、ジェネリック医薬品の治療上の同等性を保証する為に行われる。一方、台湾では、このような試験は、剤形・処方・製造工程・製造者などに変更があった際にも行われる。
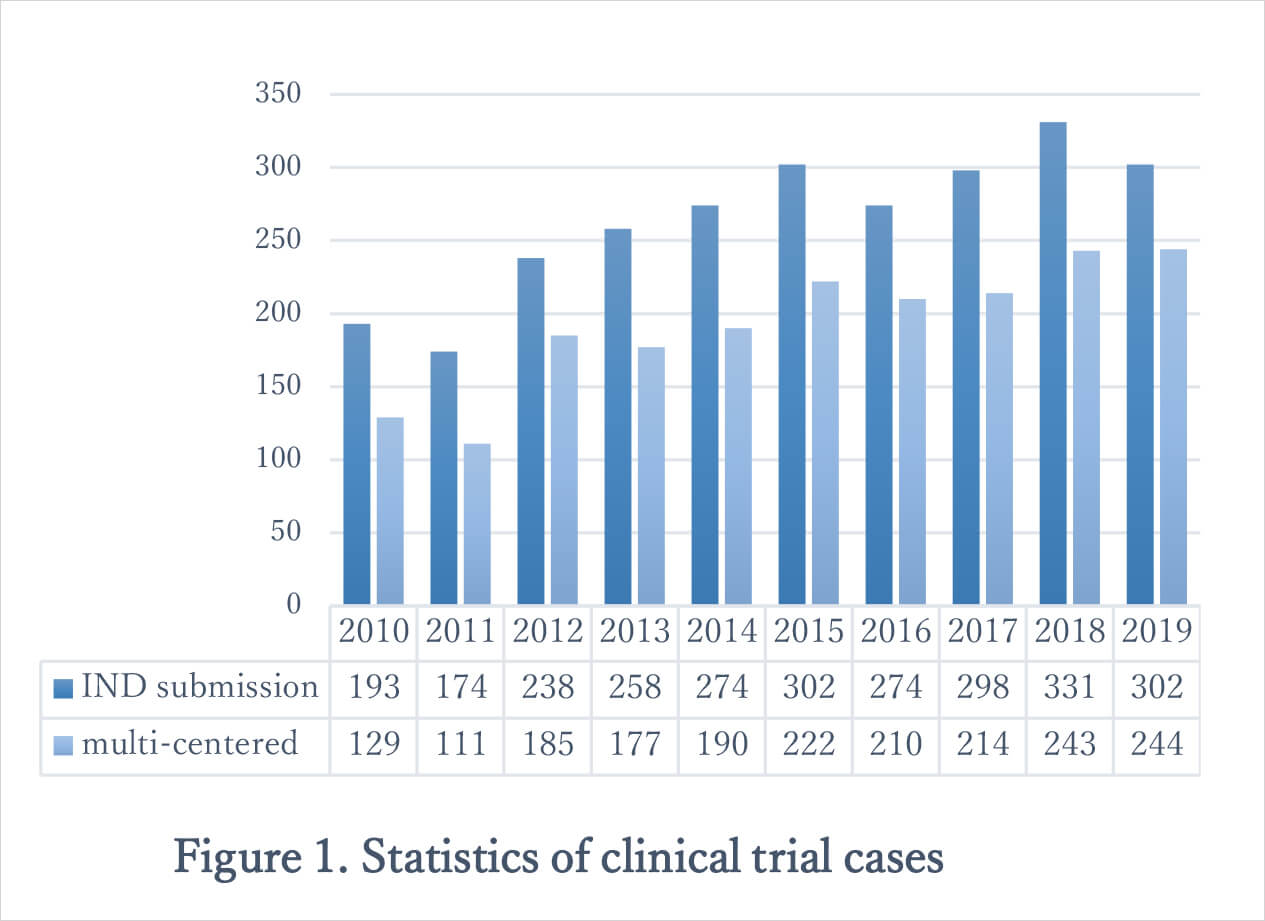
近年、医療サービスに対する台湾の可能性が世界的に注目されており、数多くの国際多施設共同試験が台湾で行われている。(2019年に台湾で行われた治験の81%が国際多施設共同試験。Figure 1を参照。)
台湾のFDA(Taiwan Food and Drug Administration/TFDA)に基づく多くの規制には、米国FDAやICHのガイドラインが参照されており、国際的基準との整合性が取れている。さらに、台湾の臨床試験環境に関する重要な情報を持った国内外のパートナーを紹介できる“Taiwan Clinical Trials”と呼ばれるワンストップサービスセンターがある。このTaiwan Clinical Trialsは、台湾衛生福利部食品薬物管理署(Ministry of Health and Welfare Taiwan)のサポートを受け、医薬品評価センター(Center for Drug Evaluation/CDE)によって管理されている。
BA/BE試験に関する法律と規則
台湾のBA/BE試験に関する規制は、”Medical Care Act”と”Pharmaceutical Affairs Act”を参照している。その他特記すべき規則としては、”Regulations on Human Trials”、”Regulations for Good Clinical Practice”、”Regulations for Registration of Medicinal Products (藥品查驗登記審查準則)”及び”Regulations for Bioavailability and Bioequivalence Studies(藥品生體可用率及生體相等性試驗作業準則)”がある。
日本でのBA/BE 試験は、“後発医薬品の生物学的同等性試験ガイドライン”、“強さが異なる経口固形製剤の生物学的同等性試験ガイドライン”及び“経口固形製剤の処方変更の生物学的同等性試験ガイドライン”に従っている。
それでは、ここでジェネリック医薬品申請に対しBE試験が行われる際における、日本と台湾の規制の違いを見てみよう。原則的に、両国間の基本的な要件は似ている。例えば、対象医薬品間で生物学的利用能に有意差が見られない時に、生物学的同等性が認められる。BA試験からのデータが十分でない時、医薬品の治療的効果の同等性を証明する為に臨床試験の実施が求められる。また、試験デザイン・ウォッシュアウト期間・検体を採取する時期及び検体の選択は一致していなければならない。
しかし、二か国間の重要な違いは、BE試験を免除する為の条件の違いである。日本では、使用時に水溶液である静脈注射用製剤(IV)のみ、BE 試験が免除になる可能性がある。台湾では、静脈注射剤、有効成分の吸収に影響を与える可能性のある添加物を含まない経口液剤のジェネリック医薬品、血管外注射製品、吸引ガスや吸入薬などの製品、局所的なジェネリック医薬品、眼科・耳鼻科用のジェネリック医薬品、その他の指定医薬品等、様々なジェネリック医薬品に対して、BE試験免除の可能性が……
全文&最新号は
メールマガジン「Global Newsletter」にて
メールマガジン「Global Newsletter」では、アジアをはじめとした世界各地の臨床試験のガイドライン改正等の最新情報を無料でお届けしています。ぜひ下記フォームよりお申込みください!